ОПУХОЛИ ДОБРОКАЧЕСТВЕННЫЕ И ЗЛОКАЧЕСВЕННЫЕ - В ЧЕМ РАЗНИЦА?
Клетки организма объединены в ткани - однородные группы с общим происхождением, функцией и общей территорией. Типичные ткани - эпителии, то есть покровные или пограничные ткани, например эпителии кишечника, желудка или кожи.
Число клеток в данной ткани более или менее постоянно. Естественная убыль клеток пополняется из молодых отделов ткани, содержащих низкоспециализированные, делящиеся клетки. Темп их деления определяется потерей зрелых, функционирующих клеток. Этот темп контролируется ростовыми факторами, выработка которых каким-то образом определяется потребностями данной ткани в пополнении. Если баланс убыль-пополнение по каким-либо причинам нарушается в пользу пополнения, то возникает избыточная масса клеток и в том месте, где этот баланс нарушен, образуется опухоль. Опухоль может возникнуть и постепенно исчезнуть, может длительное время увеличиваться, но не это определяет ее доброкачественный или злокачественный характер. Всякая ткань занимает лишь свою территорию - как вширь, так и вглубь. Если она не выходит за пределы своей территории и не внедряется в подлежащие или соседние ткани, то эта опухоль доброкачественная. В самом деле, ее хирургическое удаление вместе с участком молодых клеток, ее пополняющих, прекращает существование этой опухоли. Как правило, она не возобновляется, но если и возобновляется, то ее повторное удаление не составляет какой-либо сложности.
Другое дело - опухоль злокачественная. Ее главный признак - выход за пределы территории, предназначенной для данной ткани. Если опухоль врастает в подлежащую ткань, то говорят об инвазии (внедрении). Инвазия - первый признак злокачественной опухоли. Если опухолевые клетки отрываются от основного очага, разносятся лимфой и кровью по организму, оседают в других, отдаленных органах (обычно в лимфатических узлах, печени, легких) и образуют там вторичные, отдаленные очаги опухолевого роста, то говорят о метастазировании, то есть о распространении опухолевого процесса по организму. Особенно опасны микрометастазы, мельчайшие очажки опухолевого роста, которые зачастую нельзя ни увидеть, ни удалить хирургически. Микрометастазы можно настичь только противоопухолевыми препаратами, попадающими после введения в кровь.
Чем же определяется злокачественный характер опухоли? Прежде всего автономностью роста, то есть его неконтролируемостью со стороны организма [1, 2]. Автономность опухоли проявляется в неограниченности ее роста. Опухоль не чувствует объема той ткани, к которой принадлежит. Ее масса ничем не ограничена. Если опухоль уже не помещается в животном, ее можно пересадить другому животному и получить перевиваемую опухоль, которая будет неограниченно расти столько, сколько ее будут перевивать. Перевиваемые опухоли сохраняют свои свойства и являются бесценным материалом для экспериментальной онкологии. Клетки опухоли могут размножаться и пересеваться в пробирке - в культуре ткани. Само существование перевиваемых опухолей говорит о том, что опухоль самодостаточна, что причина ее роста в ней самой, так как перенос в нормальный организм здорового животного ее роста не останавливает. Все свое несет с собой, да к тому же ничему не подчиняется.
Автономность проявляется также в независимости от окружающих тканей. Окружающие ткани останавливают рост соседних тканей, если они выходят за границы своей территории. Злокачественные опухоли не чувствуют этих влияний, по крайней мере в должной степени. Они внедряются на чужие территории (инвазия), и что самое важное - они способны расти в чужом окружении или, как говорят, в чужом микроокружении. Причем существенно то, что клетки, оторвавшись от опухоли, могут расти отдельно от нее в чужеродном микроокружении. Способность к метастазированию - это не столько способность к отрыву и распространению, сколько именно к росту на чужих территориях, в чуждом микроокружении. Метастазы - это то, что делает опухоль поистине злокачественной.
Следующим неотъемлемым свойством злокачественной опухоли является бессмертие ее клеток. Нормальные клетки смертны, их жизненный цикл включает запрограммированную смерть - апоптоз [3]. Будучи высажены в культуру, они погибают, пройдя несколько циклов деления. Клетки опухоли не знают предела для размножения ни в организме, ни вне его - они бессмертны.
Очень важным и обязательным признаком злокачественной опухоли является ее моноклональность. Злокачественная опухоль развивается из одной генетически измененной клетки. В этом смысле она представляет собой клон, то есть потомство генетически однородных клеток, возникших из одной клетки. Конечно, в череде генераций в опухоли возникают мутации, которые порождают новые, вторичные клоны, создающие генетическую разнородность внутри опухоли, но это вторичная разнородность. Вначале опухоль - это клон клеток, возникший из одной трансформированной, то есть превращенной в злокачественную, клетки.
Опухоль непрерывно прогрессирует к большей злокачественности. Накопление в ней мутаций, ведущее к расширяющемуся разнообразию клонов, создает богатый материал для отбора наиболее быстроразмножающихся и наиболее автономных клеток. Эти клетки обгоняют в темпе размножения и способности распространения своих соседей и создают основу для опухолевой прогрессии - непрерывной эволюции опухоли в сторону все более агрессивной и неконтролируемой ткани.
В процессе опухолевой прогрессии постепенно стираются признаки исходной ткани, так как они зачастую являются мишенью для контроля опухоли со стороны организма или соседних тканей. Но признаки происхождения никогда не исчезают полностью. Опухоль всегда несет печать той ткани, из которой она возникла. И эта очень важная особенность опухоли, позволяющая точно определить, где и из чего она возникла и к какому лечению будет чувствительна.
Таковы биологические особенности опухоли, определяющие ее злокачественный характер. Что лежит в их основе? Анализ биологии опухолевой клетки мы начнем с причин, ведущих к возникновению опухолей.
ОНКОГЕНЫ И АНТИОНКОГЕНЫ
Даже самый общий, "с птичьего полета", взгляд на проблему показывает, что речь идет об очень редком (на клеточном уровне) событии - трансформации одной клетки из миллиардов, о возникновении единичных клонов при действии массивных доз канцерогенных веществ или облучения на громадные клеточные территории либо об образовании одиночных опухолей при массовом заражении множества клеток опухолеродными вирусами. Причем каждое из этих воздействий (канцерогены, облучение) может вызвать либо классическую мутацию, либо изменения в генетическом аппарате клетки (интеграция вируса). Существование наследуемых опухолей и специфических хромосомных транслокаций в опухолях уже прямо свидетельствовало о генетическом повреждении как причине рака (транслокация - перенос участка одной хромосомы на другую). Стабильность злокачественных свойств в трансформированных клетках и их передача из клеточного поколения в поколение также говорили в пользу генетической природы злокачественности. Но самые прямые доказательства этого положения и пути для выявления конкретных генов, ответственных за опухолевую трансформацию, дали вирусы.
Вирусная нуклеиновая кислота содержит гены, кодирующие структурные вирусные белки и белки, необходимые для размножения вируса (например, ревертазы у ретровирусов). Вирусные гены, как и клеточные гены, могут мутировать, создавая новые варианты вирусов. Среди таких мутаций встречаются термозависимые мутации, которые проявляются только при определенной (пермиссивной, то есть разрешающей) температуре. В начале 70-х годов были получены такие термозависимые мутанты вируса саркомы, которые трансформировали клетки только при пермиссивной температуре. Это значит, что один из генов вируса был активен только при такой температуре. Более того, свойства злокачественности этих клеток сохранялись только при пермиссивной температуре. Отсюда следовало, что одного гена вируса саркомы достаточно и для того, чтобы вызвать опухолевую трансформацию клетки, и для того, чтобы поддерживать ее. Инактивация этого гена в непермиссивной температуре возвращала клетку в нормальное состояние. Итак, в вирусе саркомы содержится один ген, вызывающий и поддерживающий злокачественность. Этот, тогда не идентифицированный еще ген был назван онкогеном, то есть опухолевым геном. Сравнение близких вариантов вируса, вызывающих и не вызывающих опухоль, то есть содержащих и не содержащих онкоген, прямыми молекулярно-биологическими методами позволило идентифицировать участок РНК в ретровирусе, содержащий этот ген, а затем и выделить его. Это было сделано в конце 70-х годов. Первый онкоген, названный src, был выделен из вируса куриной саркомы. Вскоре было показано, что искусственное введение гена src в генетический аппарат клетки трансформирует ее без вируса. Один-единственный ген, введенный в клетку, превращал ее в опухолевую! Вскоре после открытия src-гена были открыты и другие вирусные онкогены: myc, ras, abl и многие другие [6]. Стало ясно, что опухолевые вирусы вызывают опухоли не сами по себе, а внося в генетический аппарат клетки онкоген и закрепляя его в геноме клетки. Если онкоген удалить из генетического аппарата вируса, то вирус, не лишаясь способности размножаться и интегрировать с геномом клетки, утратит способность трансформировать клетки.
Эти замечательные открытия, следовавшие одно за другим, поставили много новых вопросов. И главный среди них: а есть ли онкогены в опухолях невирусного происхождения? Ответ на этот вопрос был вскоре получен. Оказалось, что во всех нормальных клетках есть гены, очень близкие по структуре к вирусным онкогенам, - они были названы протоонкогенами [7]. Эти гены регулируют нормальное поведение клетки - ее ответы на ростовые факторы, на гормоны, нормальный темп и "расписание" ее делений. Протоонкогены находятся под тщательным и жестким контролем других генов. Мутации протоонкогенов выводят их из-под воздействия контролирующих генов, делают их автономными. Как правило, опухолеродное действие различных канцерогенных факторов приводит к постоянной, не выключающейся активности протоонкогена. Так, хромосомные транслокации ведут к тому, что протоонкоген попадает под контроль постоянно действующего в данной ткани гена, и он работает непрерывно, не давая клетке выйти из цикла делений (myc), или посылая непрерывные сигналы с мембраны в ядро (ras), или приводя к синтезу ростовых факторов, посылающих для той же клетки сигналы к делению (аутокринная стимуляция). Некоторые опухолевые вирусы сами по себе не содержат онкогена, но, встраиваясь в хромосому рядом с протоонкогеном, активируют его, вызывая его непрерывную активность ("вставочный" канцерогенез). Канцерогенные вещества и облучение обладают высокой мутагенной активностью, вызывая мутации в различных генах, в том числе и в протоонкогенах. Эти мутации могут вести либо к нарушению регуляции протоонкогена, и тогда он выходит из-под контроля, либо к изменению свойств белка, контролируемого этим геном. Вирусы вносят онкоген, как правило не регулируемый клеткой и, кроме того, контролирующий синтез "онкобелка" с измененными свойствами, и этот онкобелок вызывает уже те процессы, которые определяют характерное асоциальное поведение клетки. Активация онкогенов лежит в основе не только индуцированных канцерогенными веществами, вирусами и облучением опухолей, но и опухолей спонтанных. И здесь речь идет о спонтанных мутациях или мутациях, вызванных неким неидентифицированным фактором.

Итак, общим звеном в возникновении опухолей является онкоген, внесенный в клетку вирусом, или возникший из протоонкогена в результате мутации, или выведенный из-под контроля сдерживающих генов хромосомной транслокацией [7]. Но в последние годы найдено еще одно, по-видимому, наиболее общее звено канцерогенеза - гены-супрессоры опухолей, подавляющие активность онкогенов [8]. Главный представитель этих генов - ген, контролирующий синтез белка р53 (р53 - от protein, белок, молекулярный вес которого 53 000 дальтон). Этот ген, вернее, его продукт р53 жестко контролирует активность протоонкогенов, разрешая ее только в строго определенные периоды жизни клетки, когда, например, надо, чтобы клетка вступила в процесс деления. р53 контролирует также апоптоз, запрограммированную гибель клетки, направляя клетку к самоубийству, если у нее поврежден генетический аппарат - ее ДНК. Тем самым р53 стабилизирует генетическую структуру клетки, предотвращая появление вредоносных мутаций, в том числе и опухолеродных. Онкогены некоторых вирусов связывают р53 и инактивируют его, а это ведет к освобождению клеточных протоонкогенов, отмене апоптоза и тем самым к накоплению жизнеспособных мутаций в клетке.
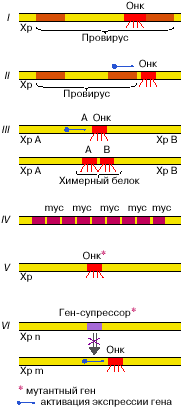 |
| Рис. 1. Происхождение и активация онкогенов: I - вирусный онкоген: часть вирусного генома, интегрированного в хромосому хозяина (провирус). Онк - онкоген; Хр - хромосома (онкогены ретровирусов: src, myc, ras, erb); II - активация клеточного онкогена встроенным провирусом (онкоген Int-1 при раке молочных желез мышей); III - хромосомные транслокации - разрыв и воссоединение фрагментов разных хромосом в единую новую хромосому могут привести к активации онкогена или образованию нового онкогена. В первом случае молчащий регуляторный ген попадает под контроль работающего клеточного гена и сам активируется (ген myc при лимфоме Бэркитта); во втором случае в месте разрыва - воссоединения образуется новый химерный ген, ведущий к синтезу химерного белка (белок bcr-abl при хроническом миелолейкозе); IV - амплификация (увеличение числа копий протоонкогена), ведущая к опухолевой трансформации (амплификация гена myc при опухолях нервной системы); V - мутация протоонкогена - синтез мутантного онкобелка (c-ras, при спонтанных и канцерогенных опухолях); VI - инактивация или утрата гена-супрессора опухолевого роста, ведущая к активации онкогена (ген RB при ретинобластоме человека; ген р53 при разных опухолях человека) |
Такие клетки представляют собой благоприятный материал для отбора на автономность, то есть к выходу на путь, ведущий к образованию опухолей. Многие, если не большинство опухолей человека возникают путем ступенчатой эволюции, в начале которой лежит инактивация гена р53 путем его случайной или индуцированной мутации или инактивации вирусным онкогеном. Типы онкогенов и антионкогенов представлены на рис. 1 и в табл. 1.
Таким образом, мы видим, как строится понимание того, что такое опухоль. Исследования в этой области растут по экспоненте, и картина разворачивается буквально на глазах. Похоже, что проблема выходит на финишную прямую, ведущую к созданию общей теории злокачественного роста. Главная проблема сегодняшней онкологии - это природа метастазирования: что позволяет клетке поселяться и давать вторичные очаги опухоли на чужой территории? Ясно уже, что это редкий и генетически контролируемый признак - редкая мутация (или мутации), возникающая в опухоли и отбирающаяся в процессе прогрессии под давлением отбора. Становится ясным, что этот признак включает способность опухолевой клетки взаимодействовать с чужеродным матриксом, то есть внеклеточным веществом, выделяемым клетками соединительной ткани. Есть данные о том, что клетки метастазов не реагируют на нормализующее влияние окружающих нормальных тканей и потому легко могут развиваться в нормальном окружении. Во всяком случае, сегодня здесь проходит граница между известным и неизвестным и здесь фокусируются внимание и интерес исследователей рака. Но нельзя ждать решения всех теоретических проблем в изучении рака. Надо предупреждать его возникновение, диагностировать опухоль как можно раньше, пока еще не образовались метастазы, надо удалять опухоль хирургически и добивать метастазы химическими препаратами.
ЛИТЕРАТУРА
1. Васильев Ю.М. Социальное поведение нормальных клеток и антисоциальное поведение опухолевых клеток. I. Сигнальные молекулы, вызывающие размножение и гибель клеток // Соросовский Образовательный Журнал. 1997. N 4. С. 17-22.
2. Васильев Ю.М. Социальное поведение нормальных клеток и антисоциальное поведение опухолевых клеток. II. Клетки строят ткань // Там же. N 5. С. 20-25.
3. Агол В.И. Генетически запрограммированная смерть клеток // Там же. 1996. N 6. С. 20-24.
4. Курение и здоровье: (Материалы МАИР) / Под ред. Р.П. Заридзе. М.: Медицина, 1989.
5. Киселев Л.Л., Абелев Г.И., Киселев Ф.Л. Как Сирано де Бержерак, он мог гордиться белым султаном своего боевого шлема: К 100-летию со дня рождения Л.А. Зильбера // Природа. 1994. N 6. С. 66-84.
6. Журн. Всесоюз. хим. о-ва им. Д.И. Менделеева. 1986. Т. 31, N 3.
7. Альбертс Б., Брей Б., Льюис Дж. и др. // Молекулярная биология клетки. М.: Мир, 1994. Т. 3.
8. Sci. Amer. Spec. Iss. 1996. N 9.
* * *
Гарри Израилевич Абелев, доктор биологических наук, профессор, академик РАН и РАЕН, руководитель лаборатории иммунохимии НИИ канцерогенеза ОНЦ РАМН им. Н.Н. Блохина. Автор более 220 научных работ, одной монографии.
01.11.2008
